近日,微生物技术国家重点实验室高翔团队在肠道拟杆菌分泌的泛素同源蛋白BUbb介导菌间拮抗特异性的机制方面取得重要进展,相关研究成果以“A highly conserved SusCD transporter determines the import and species-specific antagonism of Bacteroides ubiquitin homologues”为题发表在Nature Communications杂志上。山东大学博士生童明、博士后徐京华、博士生李伟勋以及研究员姜昆为论文共同第一作者,山东大学高翔教授为该论文的通讯作者,山东大学为第一完成单位和通讯作者单位。

拟杆菌门是人体肠道中最丰富的革兰氏阴性菌门,是人体肠道的常驻菌群,在维持肠道稳态、调节宿主免疫反应等方面发挥着至关重要的作用。尽管大多数拟杆菌被认为是共生菌,但某些物种,如产肠毒素脆弱拟杆菌(ETBF),是临床感染中常见的机会致病菌,在肠道或其他部位可表现出致病性,并与炎症性肠病(IBD)和结直肠癌(CRC)等肠道疾病相关。在复杂而拥挤的肠道生态系统中,拟杆菌通过剥削性和干扰性竞争,争夺资源和空间,从而塑造微生物群落。其中剥削性竞争驱动细菌进化出了多糖利用基因座(PULs)用以分解复杂的碳水化合物,适应不断变化的肠道环境。干扰性竞争则依赖于拮抗因子,如VI型分泌系统(T6SS)和扩散性毒素,用于实现种间和种内杀伤。高翔课题组前期的工作发现脆弱拟杆菌通过分泌类泛素蛋白(BfUbb),靶向一种特定的细菌周质蛋白——肽基-脯氨酰顺反异构酶(PPIase),实现高效的种内拮抗(Nature Microbiology, 2024)。然而,BfUbb如何进入靶细菌的周质空间及其是否具备种间拮抗作用仍不清楚。
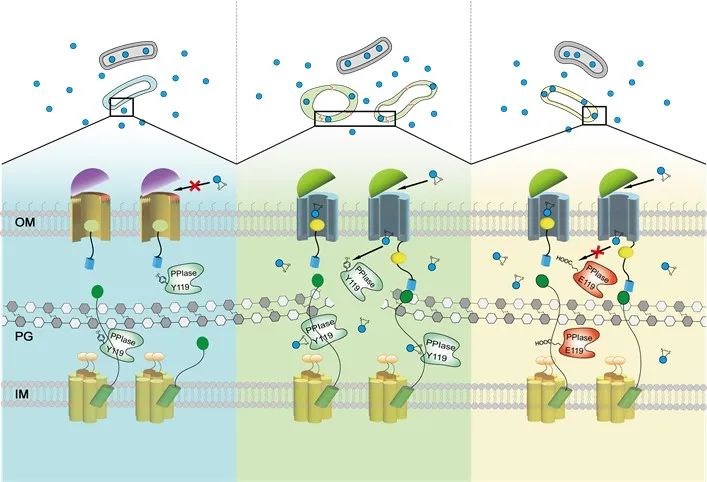
在该研究中,研究人员鉴定出了一种独特且保守的TonB依赖性转运蛋白体SusCD(命名为ButCD,意为拟杆菌类泛素同源物(BUbb)转运蛋白SusCD),这类转运蛋白是拟杆菌最主要的营养转运系统,该转运蛋白体被BfUbb利用,将BfUbb转运到受体细胞的周质空间,实现种内杀伤。尽管ButCD的同源蛋白在其他拟杆菌物种中广泛存在,但一些编码BfUbb敏感型PPIase的拟杆菌因其ButCD与脆弱拟杆菌的ButCDBf序列相似性较低,不能介导BfUbb的跨膜转运,从而避免被BfUbb杀伤。进一步研究发现,ButCD在决定BUbb物种特异性拮抗中发挥了关键作用,因为它同样被来自卵形拟杆菌(Bo)的另一BUbb(BoUbb)劫持,用于拮抗耐受BfUbb的其它几种拟杆菌(Bt, Bo, Bx)。BfUbb-ButCDBf复合物的冷冻电镜结构揭示了ButCD的独特结构特征,这些特征保证了BfUbb的结合和运输。动物实验进一步证明,BfUbb 能特异、高效地消除小鼠肠道中的ETBF,因此BfUbb有望在炎症性肠病(IBD)和结直肠癌(CRC)治疗中发挥作用。
综上所述,该研究全面阐明了拟杆菌类泛素同源物特异性拮抗机制背后的多种影响因素,并探讨了其潜在的应用价值。该研究工作得到了国家重点研发计划、国家自然科学基金、山东省自然科学基金等基金的资助。山东大学微生物技术国家重点实验室生命环境研究公共技术平台为本工作提供了重要技术支持。
文章链接:https://doi.org/10.1038/s41467-024-53149-w