近日,山东大学微生物技术国家重点实验室高翔团队在mBio上发表了题为“Molecular insights into the assembly and functional diversification of typhoid toxin” 的研究论文。
人伤寒沙门氏菌是专一侵染人类的病原菌,会引发伤寒,每年导致世界上近一千万人感染,超过11万人死亡。伤寒毒素是人伤寒沙门氏菌的关键毒力因子,在小鼠上注射伤寒毒素会复现人伤寒的症状。伤寒毒素具有独特的A2B5结构,不同于其他的AB5毒素,它含有2个活性亚基(A亚基,PltA 和CdtB)和一个五聚体的转运亚基(B亚基,PltB)。近期的研究发现,在人伤寒沙门氏菌基因组中远离伤寒毒素基因岛的地方,还存在另一个PltB的同源蛋白,PltC,也可以和CdtB,PltA形成有活性的A2B5细菌毒素,但其活性和功能与PltB伤寒毒素有显著的差别。基于此,我们探索了伤寒毒素组装和功能多样性的分子机制。
首先,我们发现PltB和PltC是不能形成杂合五聚体的,其主要原因是PltB和PltC相互作用的界面上存在非常强的电荷排斥作用,因此只有PltB伤寒毒素,PltC伤寒毒素,没有PltB/PltC杂合的伤寒毒素。
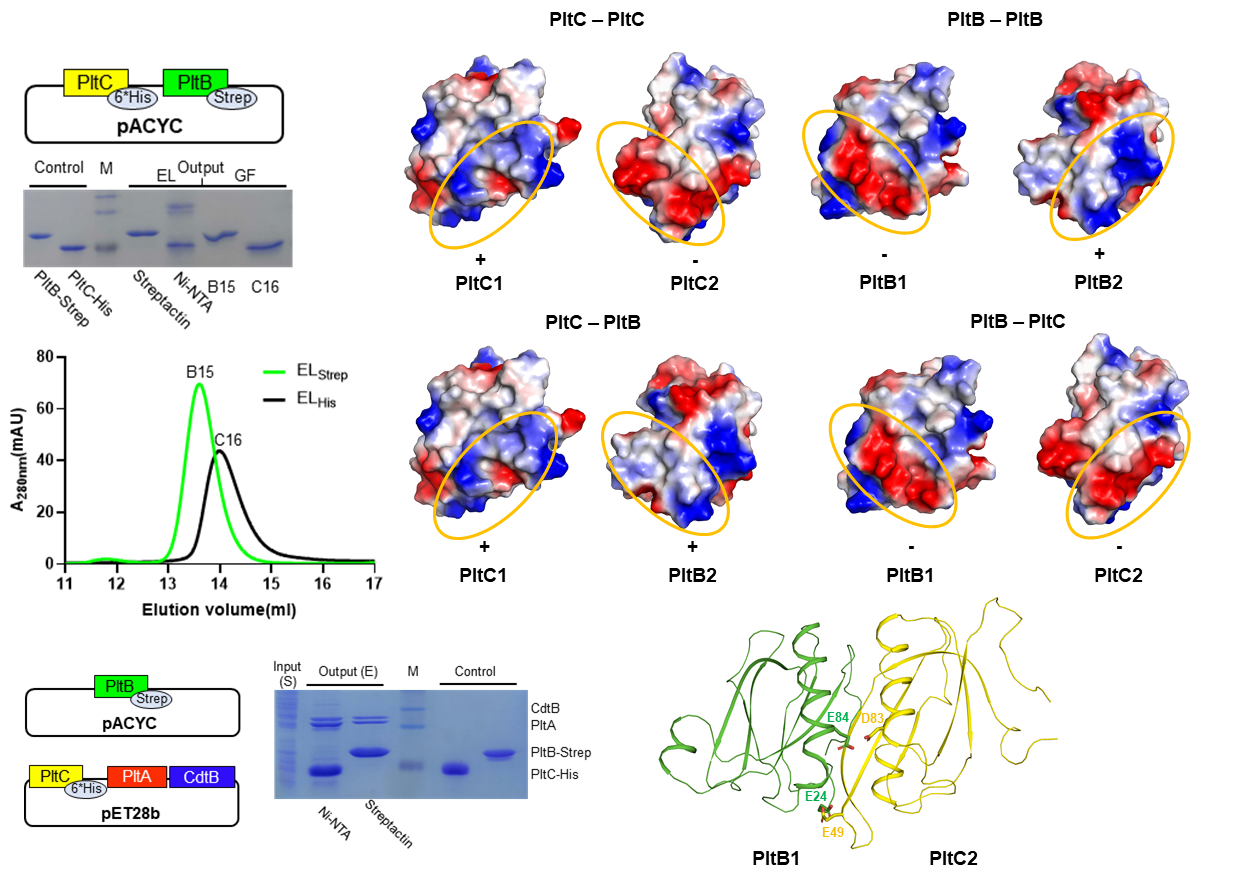
进一步的研究表明,PltC不但不会和PltB形成杂合五聚体,还会和PltB竞争性结合PltA-CdtB,形成A2B5细菌毒素,分子动力学模拟的结果显示PltC是通过与PltA更强的库伦力与PltB竞争的。
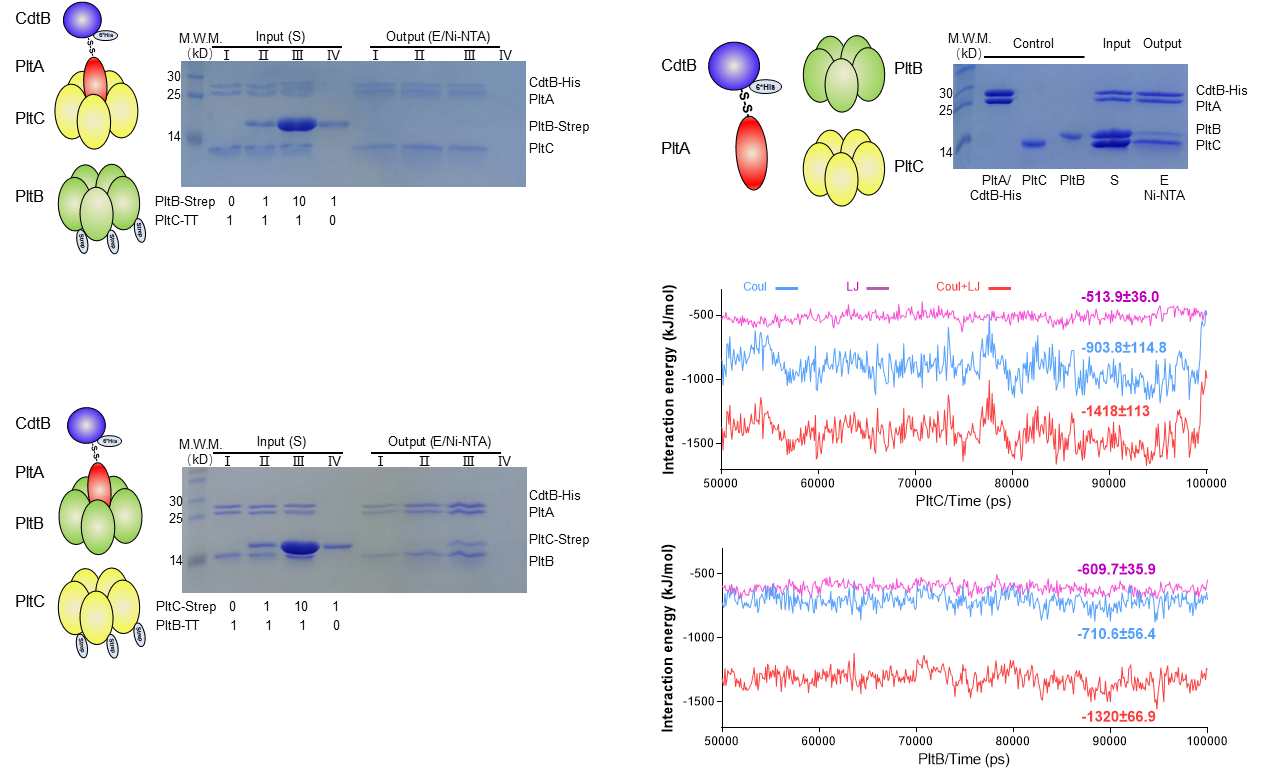
同时我们还发现PltC和PltB有截然不同的糖识别特异性,从而导致对不同组织的细胞毒性有明显的差别。
综上,我们的工作初步揭示了人伤寒沙门氏菌组装和功能多样性的分子基础,展示了伤寒毒素复杂的生物特性,为进一步理性的开发针对伤寒毒素的新一代疫苗,以及设计小分子抑制剂来预防和治疗伤寒提供了理论基础。
高翔教授为该研究的通讯作者,高翔团队博士研究生刘晓宇为本研究的第一作者,博士研究生陈喆、实验师焦绪瑶、山东大学生命科学学院本科生邱继承、国家糖工程研究中心副研究员蒋绪凯参与了该研究工作。此外,加拿大阿尔伯塔大学生物科学系的助理教授Casey C. Fowler、中国海洋大学进化与海洋生物多样性研究所的龙红岸教授、北京大学系统生物医学研究所的游富平教授和国家糖工程研究中心的曹鸿志教授也为该研究工作提供了帮助和指导。
该研究工作得到了国家重点研发计划项目、国家自然科学基金委面上项目、优秀青年项目、山东省自然科学基金重大基础计划项目、泰山学者(青年)项目及山东大学青年交叉创新团队等基金的资助。山东大学生命环境研究公共技术平台和上海同步辐射光源为本工作提供了重要支持。
原文链接:https://journals.asm.org/doi/epub/10.1128/mbio.01916-21